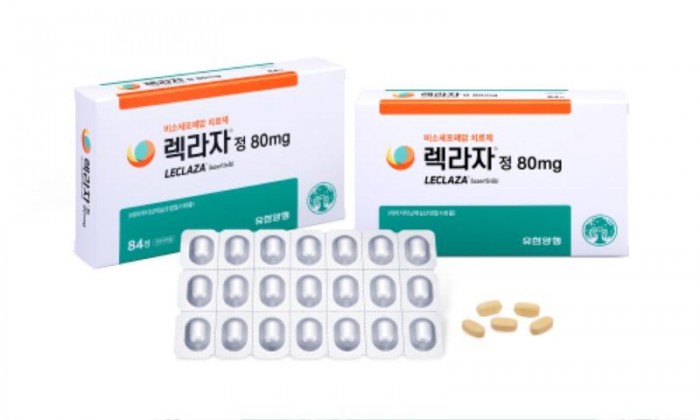
2024.05.05 (일)
 속초15.9℃
속초15.9℃ 17.3℃
17.3℃ 철원17.4℃
철원17.4℃ 동두천18.0℃
동두천18.0℃ 파주18.6℃
파주18.6℃ 대관령15.6℃
대관령15.6℃ 춘천17.3℃
춘천17.3℃ 백령도13.9℃
백령도13.9℃ 북강릉19.0℃
북강릉19.0℃ 강릉20.1℃
강릉20.1℃ 동해17.0℃
동해17.0℃ 서울18.6℃
서울18.6℃ 인천18.2℃
인천18.2℃ 원주18.5℃
원주18.5℃ 울릉도16.1℃
울릉도16.1℃ 수원18.2℃
수원18.2℃ 영월17.3℃
영월17.3℃ 충주18.2℃
충주18.2℃ 서산19.9℃
서산19.9℃ 울진13.8℃
울진13.8℃ 청주18.7℃
청주18.7℃ 대전18.2℃
대전18.2℃ 추풍령16.8℃
추풍령16.8℃ 안동17.6℃
안동17.6℃ 상주17.6℃
상주17.6℃ 포항18.4℃
포항18.4℃ 군산18.9℃
군산18.9℃ 대구17.9℃
대구17.9℃ 전주20.1℃
전주20.1℃ 울산16.5℃
울산16.5℃ 창원17.0℃
창원17.0℃ 광주19.7℃
광주19.7℃ 부산17.1℃
부산17.1℃ 통영17.0℃
통영17.0℃ 목포20.2℃
목포20.2℃ 여수18.8℃
여수18.8℃ 흑산도17.8℃
흑산도17.8℃ 완도20.0℃
완도20.0℃ 고창19.5℃
고창19.5℃ 순천17.4℃
순천17.4℃ 홍성(예)19.4℃
홍성(예)19.4℃ 17.5℃
17.5℃ 제주24.2℃
제주24.2℃ 고산18.8℃
고산18.8℃ 성산19.8℃
성산19.8℃ 서귀포20.0℃
서귀포20.0℃ 진주17.7℃
진주17.7℃ 강화18.4℃
강화18.4℃ 양평18.2℃
양평18.2℃ 이천18.3℃
이천18.3℃ 인제16.7℃
인제16.7℃ 홍천17.9℃
홍천17.9℃ 태백15.7℃
태백15.7℃ 정선군17.6℃
정선군17.6℃ 제천17.0℃
제천17.0℃ 보은17.6℃
보은17.6℃ 천안18.2℃
천안18.2℃ 보령19.9℃
보령19.9℃ 부여18.9℃
부여18.9℃ 금산18.2℃
금산18.2℃ 18.3℃
18.3℃ 부안19.9℃
부안19.9℃ 임실18.2℃
임실18.2℃ 정읍20.6℃
정읍20.6℃ 남원19.7℃
남원19.7℃ 장수17.5℃
장수17.5℃ 고창군19.7℃
고창군19.7℃ 영광군20.3℃
영광군20.3℃ 김해시16.6℃
김해시16.6℃ 순창군19.0℃
순창군19.0℃ 북창원17.8℃
북창원17.8℃ 양산시18.2℃
양산시18.2℃ 보성군19.8℃
보성군19.8℃ 강진군21.0℃
강진군21.0℃ 장흥20.1℃
장흥20.1℃ 해남21.0℃
해남21.0℃ 고흥20.1℃
고흥20.1℃ 의령군18.1℃
의령군18.1℃ 함양군18.0℃
함양군18.0℃ 광양시17.5℃
광양시17.5℃ 진도군19.8℃
진도군19.8℃ 봉화16.4℃
봉화16.4℃ 영주16.4℃
영주16.4℃ 문경16.8℃
문경16.8℃ 청송군17.5℃
청송군17.5℃ 영덕17.0℃
영덕17.0℃ 의성18.0℃
의성18.0℃ 구미18.0℃
구미18.0℃ 영천17.6℃
영천17.6℃ 경주시17.9℃
경주시17.9℃ 거창16.6℃
거창16.6℃ 합천18.0℃
합천18.0℃ 밀양17.5℃
밀양17.5℃ 산청17.3℃
산청17.3℃ 거제17.6℃
거제17.6℃ 남해18.0℃
남해18.0℃ 18.0℃
18.0℃


 전체
전체